Сектор молекулярной генетики человека
Текущие задачи решаемые группой.
Фундаментальные исследования:
- Роль гибридного гена aml1/eto в поддержании t(8;21)(q22;q22)-положительной формы острого миелоидного лейкоза человека.
- Соотношение между кумулятивным риском t(8;21)(q22;q22)-положительной формы острого миелоидного лейкоза и частотой функциональной транслокации t(8;21)(q22;q22) в популяциях людей.
- Разнообразие РНК-транскриптов гибридного гена aml1/eto и их функциональная роль.
Ориентированные фундаментальные исследования:
- Направленная генетическая модификация стволовых клеток человека с помощью лентивирусных векторов доставки.
- Создание сурогатных инсулин-продуцирующих клеток путем генетической модификации мезенхимальных стволовых клеток (МСК)человека.
- Наследственная предрасположенность к сахарному диабету I и II типа.

Верхний ряд, слева направо: Д.В.Посредник, И.Н.Ильюшёнок, В.В.Гринев, К.В.Спица, Е.Э.Костогладова. Нижний ряд, слева направо: Т.В.Романовская, А.А.Ковалевский, Н.Ю.Щеблыкина, Э.А.Николаевич.
ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ. ФУНКЦИОНАЛЬНАЯ РОЛЬ ГИБРИДНОГО ГЕНА aml1/eto ПРИt(8;21)(q22;q22)-ПОЗИТИВНОЙ ФОРМЕ ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА ЧЕЛОВЕКА.
ЧАСТЬ I. Разработка систем конститутивной и индуцибельной РНК интерференции для контроля экспрессии гибридного гена aml1/eto.
Сбалансированная транслокация t(8;21)(q22;q22) между хромосомами 8 и 21, встречаясь с частотой ~16% среди всех de novo зарегистрированных случаев острого миелоидного лейкоза, относится к наиболее распространенным генетическим нарушением, детектируемым при этом заболевании. В результате транслокации происходит объединение гена eto, который локализован на хромосоме 8, с геном aml1, находящимся на 21 хромосоме, в единый гибридный ген aml1/eto на деривате хромосомы 8. Этот ген кодирует химерный белок AML1/ETO, который, по-видимому, и играет ключевую роль в инициации t(8;21)(q22;q22)-позитивной формы острого миелоидного лейкоза. Однако при этом было установлено, что сам по себе гибридный ген aml1/eto не способен вызвать лейкоз, выяснено, что для этого нужны дополнительные (вторичные) мутации. Более того, играет ли этот ген какую-то роль в последующей прогрессии заболевания остается неизвестным. Неопределенность же роли гена aml1/eto в прогрессии лейкоза не позволяет рассматривать сам ген или его продукты (РНК или белок) как потенциальную мишень в разработке новых селективных ингибиторов для терапии острого миелоидного лейкоза.
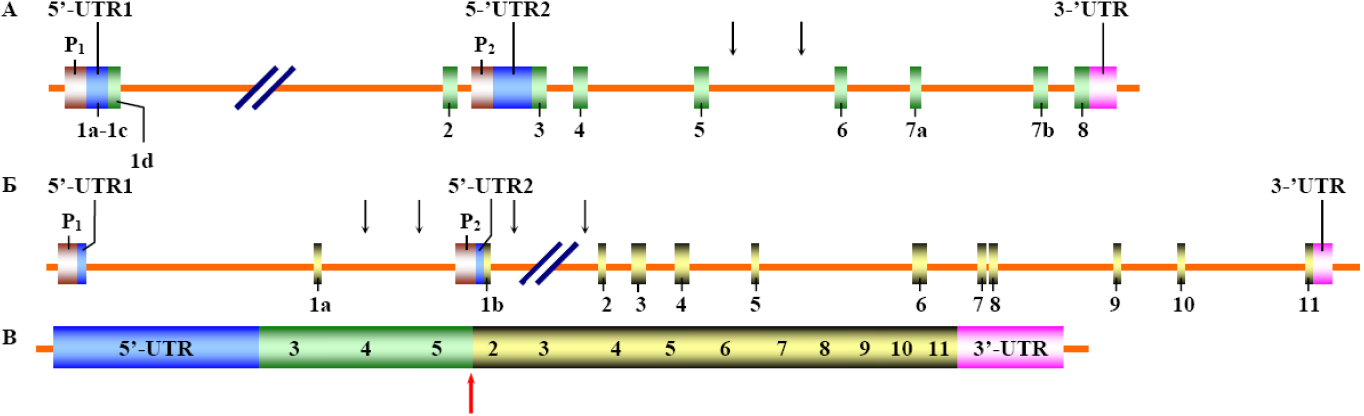
Структурная организация генов aml1 (А) и eto (Б) и мРНК гибридного гена aml1/eto (В). Черными вертикальными стрелками указаны сайты рекомбинации между генами aml1 и eto. Вертикальной красной стрелкой отмечена область слияния 5’-конца мРНК гена aml1 и 3’-конца мРНК гена eto в единой химерной мРНК гибридного гена aml1/eto. Одним из путей решения обозначенных выше проблем может быть использование РНК интерференции как способа контроля экспрессии гибридного гена aml1/eto в функциональных исследованиях этого гена на моделях ксено-трансплантанта t(8;21)(q22;q22)-положительной формы острого миелоидного лейкоза человека у лабораторных животных.
С этой целью группой была спроектирована, создана и экспериментально проверена целая серия экспрессионных кассет, обеспечивающих конститутивную или индуцибельную наработку aml1/eto-специфических искусственных микроРНК или коротких шпилечных РНК в клетках модельных линий Kasumi-1 и SKNO-1 t(8;21)(q22;q22)-положительного острого миелоидного лейкоза человека. Перенос таких экспрессионных кассет в лейкозные клетки осуществляется с помощью рекомбинантных лентивирусов, псевдотипированных гликопротеином вируса везикулярного стоматита, получаемых путем котрансфекции клеток линии 293Т эмбриональной почки человека смесью из трех векторов: вектора упаковки pCMV_dR8.91, вектора оболочки pMD2.G и соответствующего лентивирусного вектора доставки.
Полученные группой результаты указывают на высокую эффективность и специфичность РНК интерференции, запускаемой искусственными микроРНК или короткими шпилечными РНК, в отношении гибридного гена aml1/eto. Эти результаты являются основанием для начала работ по изучению функциональной роли гибридного гена aml1/eto в поддержании t(8;21)(q22;q22)-положительной формы острого миелоидного лейкоза человека на моделях in vivo.
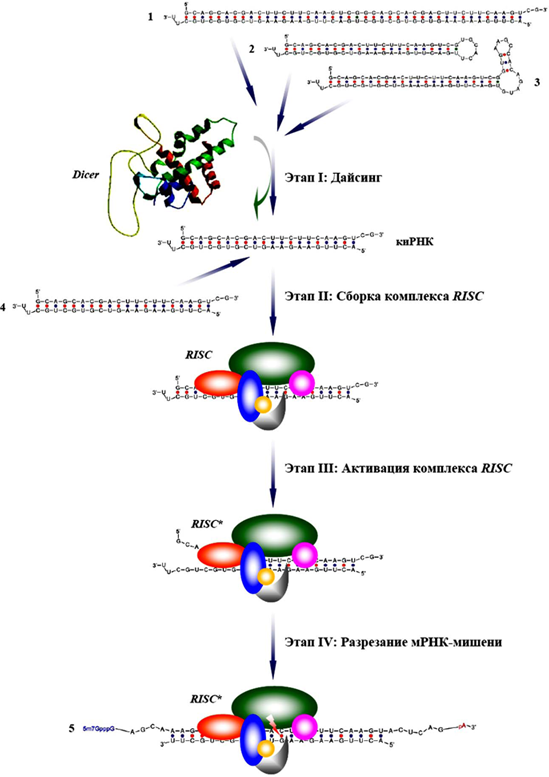
Общая схема РНК интерференции. Условные обозначения: 1) экзогенная (искусственная) или эндогенная (природная) длинная двуцепочечная РНК;2) короткая шпилечная РНК (природная или искусственная); 3) микроРНК (природная или искусственная); 4) искусственная короткая интерферирующая РНК; 5) кэппированная и полиаденилированная мРНК-мишень. В рамках рассматриваемого проекта используются только спроектированные короткие шпилечные РНК и искусственные микроРНК.
Исследования функциональной роли гибридного гена aml1/eto при t(8;21)(q22;q22)-позитивной форме острого миелоидного лейкоза человека проводятся в тесной кооперации с группой по изучению гибридных генов из Северного научно-исследовательского института рака при университете г. Ньюкасл, Великобритания.
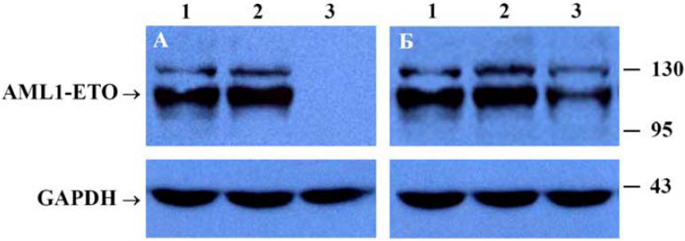
Эффективность “нокдауна” белка AML1/ETO, индуцированного анти-aml1/eto короткими шпилечными РНК (А) илианти-aml1/eto искусственными микроРНК (Б).
Показаны репрезентативные Вестерн-блоты для клеток линии SKNO-1 (1 – нетрасндуцированные клетки, 2 – клетки, трансдуцированные контрольным вектором, 3 – клетки, трансдуцированные вектором для РНК интерференции). Белковый продукт гена, кодирующего глицеральдегид-фосфат дегидрогеназу, взят в качестве контроля количества вносимого белка и контроля специфичности РНК интерференции.
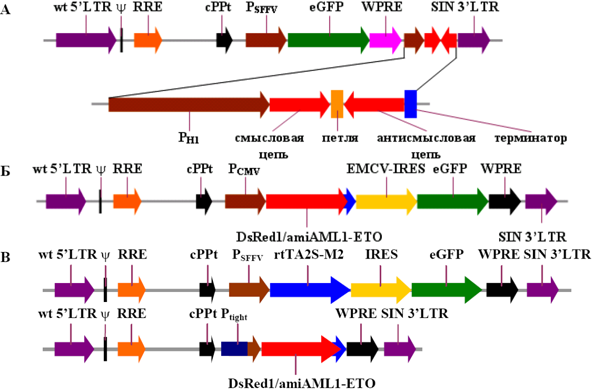
Структурная организация кассет, кодирующиханти-aml1/eto короткие шпилечные РНК (А) или искусственные микроРНК (Б и В) с конститутивной(А и Б) или индуцибельной экспрессией (В).
На рисунке экспрессионные кассеты показаны в составе лентивирусных векторов доставки. Ключевым репортерным белком, отражающим эффективность переноса экспрессионных кассет в лейкозные клетки с помощью изображенных векторов, является зеленый флуоресцирующий белок eGFP. Экспрессионная кассета, кодирующая короткие шпилечные РНК, находится под контролем промотора H1 человека и встроена вместо U3 области 3’-LTR вектора (часть А рисунка). В части В рисунка изображена сопряженная пара векторов: вектор, кодирующий тетрациклин/доксициклин контролируемый транскрипционный активатор третьего поколения rtTA2S-M2, и вектор, несущий гибридную последовательность DsRed1/amiAML1-ETO под контролем индуцибельного минимального промотора Ptight, одновременно кодирующую репортерный красный флуоресцирующий белок DsRed1 и анти-aml1/eto искусственные микроРНК. Аналогичная последовательность использована и при создании бицистронной экспрессионной кассеты, контролируемой конститутивным промотором цитомегаловируса человека PCMV (часть Б рисунка).
ОРИЕНТИРОВАННЫЕ ФУНДАМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ. КОСТНОМОЗГОВЫЕ МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ КАК ИНСТРУМЕНТ ДОСТАВКИ ex vivo ТЕРАПЕВТИЧЕСКИХ ГЕНОВ ЧЕЛОВЕКА.
МСК относительно легко выделяются из различных тканей и органов человека, включая костный мозг, пуповинную кровь, плаценту, легкие и жировую ткань. Изолированные и наращенные в условиях in vitro они сохраняют при этом ряд своих уникальных свойств, в частности, способность к самообновлению и к дифференцировке (в контролируемых in vitro условиях, мимикрирующих ситуацию in vivo) в остеобласты, хондробласты, адипоциты, миобласты, кардиомиоциты, гепатоциты и нервные клетки. Кроме того, МСК могут быть стабильно модифицированы терапевтическими генами, реимплантированы назад в организм человека и, благодаря хоминг-эффекту, они способны колонизовать специфические типы тканей, обеспечивая их регенерацию или оказывая терапевтический эффект. Таким образом, МСК являются привлекательным и многообещающим инструментом регенеративной медицины, а также способом системной доставки терапевтических генов ex vivo.
Для оценки эффективности и стабильности генетической модификации костномозговых МСК человека сопряженной парой генов мы разработали новый бицистронный лентивирусный вектор доставки pHR-CMV-DRep, кодирующий два репортерных трансгена – красный флуоресцирующий белок DsRed1 и белок eGFP с усиленный зеленой флуоресценцией.
Согласно результатам проведенных нами исследований, МСК могут быть эффективно модифицированы двумя трансгенами, переносимыми в составе одного лентивирусного вектора доставки. При использовании в качестве внутреннего регуляторного элемента промотора PCMV ранних генов цитомегаловируса человека такая модификация является стабильной на протяжении, по меньшей мере, одного месяца культивирования стволовых клеток in vitro. Кроме того, МСК разных пассажей сохраняют одинаковую чувствительность к трансдукции бицистронным лентивирусным вектором.
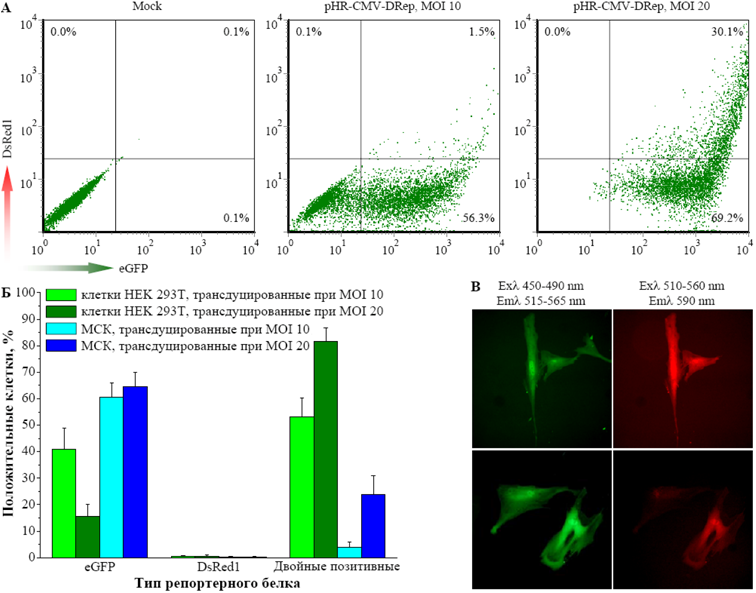
Сравнительная эффективность трансдукции клеток линии HEK 293T эмбриональной почки и костномозговых МСК человека. В части А рисунка показаны репрезентативные точечные графики распределения генетически модифицированных МСК по экспрессии репортерных белков DsRed1 и eGFP, полученные с помощью проточного цитофлуориметра FACScan. Обобщенный результат, основанный на четырех независимых экспериментах, по экспрессии индивидуальных репортерных белков представлен в части Б рисунка. В части В рисунка показаны микрофотографии генетически модифицированных МСК, полученные с помощью флуоресцентного микроскопа.
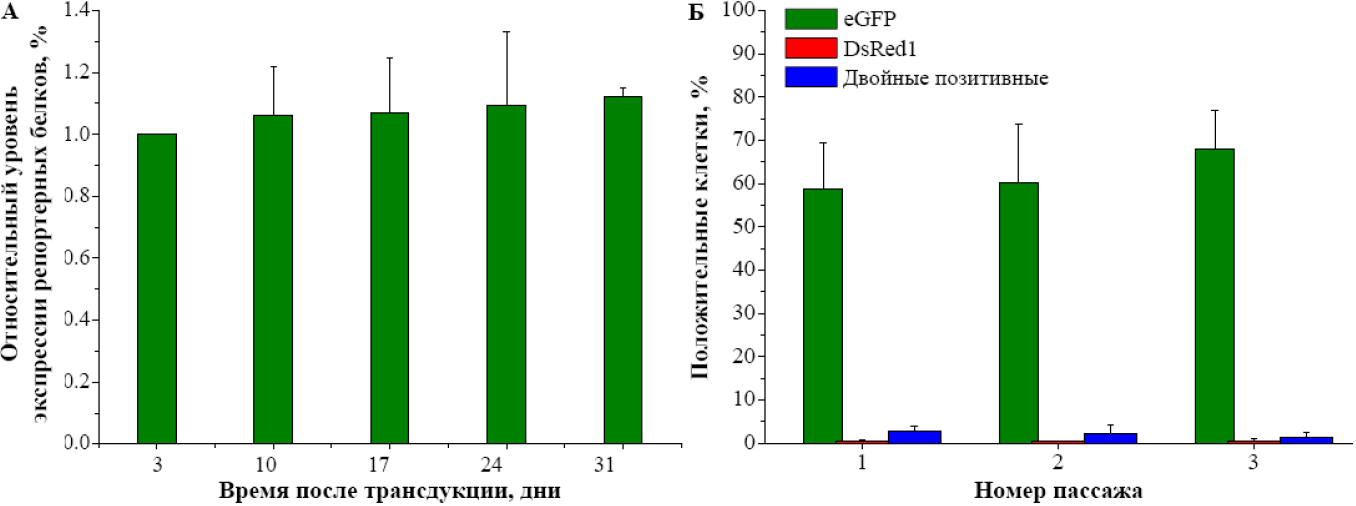
Стабильность экспрессии трансгенов в МСК, трансдуцированных бицистронным лентивирусным вектором доставки pHR-CMV-DRep (А), а также сравнительная чувствительность стволовых клеток разных пассажей (Б) к генетической модификации, проводимой с помощью лентивирусной трансдукции. На рисунке показаны обобщенные результаты трех независимых экспериментов.
Нами было показано, что генетически модифицированные клетки сохраняют гепатогенный потенциал дифференцировки и в гепатогенных условиях не только дифференцируются в гепатоцитоподобные клетки, но и поддерживают экспрессию трансгенов на более высоком уровне, чем клетки, культивируемые в негепатогенных условиях.
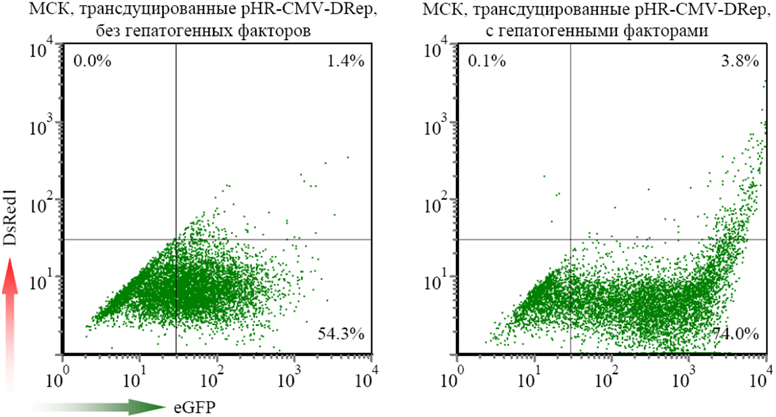
Экспрессия трансгенов в генетически модифицированных МСК, подвергшихся воздействию гепатогенных факторов.
Наши результаты дают основу для дальнейшего развития подходов направленной генетической модификации костномозговых МСК человека множеством генов в исследовательских и терапевтических целях.
Исследования проблем генетической модификации стволовых клеток человека проводятся в тесной кооперации с Лабораторией биологии и генетики стволовых клеток Республиканского научно-практического центра гематологии и трансфузиологии, г. Минск, Беларусь.
Презентация научно-исследовательской работы
